Введение
В последние годы в животноводческих хозяйствах Российской Федерации резкий скачок уровня молочной продуктивности коров за счет увеличения доли перенасыщенных энергией концентрированных кормов в рационе привел к серьезным метаболическим расстройствам организма животных, таким как ацидоз, снижение переваримости питательных веществ, нарушение синтеза ЛЖК и др. Основным фактором нарушения нормального рубцового пищеварения высокопродуктивных коров считают антропогенное давление: несоблюдение оптимальной, физиологически обоснованной структуры рациона. Так, отмечают, что при избыточном высококонцентрированном кормлении, целью которого является увеличение уровня молочной продуктивности, часто наблюдается развитие метаболических расстройств: ацидоза, кетоза и вторичной остеодистрофии (Brown et al., 2006).
К основному типу нарушения функции рубца в ветеринарной практике относят ацидоз – расстройство метаболизма, связанное с избыточным образованием молочной кислоты в рубце. Как правило, ацидоз встречается у высокопродуктивных животных и сопровождается потерей веса, ухудшением аппетита, падением продуктивности. Лактатный ацидоз влечет целый каскад нарушений состояния здоровья: некроз стенок рубца, ламиниты, маститы, эндометриты, что приводит к ранней выбраковке животных и снижению продуктивного долголетия до 2-3 лактаций. Это влечет огромные экономические потери.
По мнению ряда ученых, проблемы нарушения метаболизма у КРС связаны с нарушением микробиома рубца на фоне несбалансированного кормления, использования некачественных кормов. Дело в том, что симбиотические микроорганизмы рубца КРС являются единственным источником некоторых ферментов (целлюлаз, ксиланаз и т. п.), участвующих в расщеплении растительных полисахаридов (Van Soest, 1994). Тем не менее до недавнего времени не удавалось получить четких доказательств наличия взаимосвязи между микробиотой рубца со здоровьем и продуктивностью животных в связи с ограничением методологии исследования состава микробного сообщества, представленного преимущественно анаэробными видами. В последние годы с применением молекулярно-генетических подходов показано, что до 90% микробиоты рубца представлено некультивируемыми и неидентифицируемыми таксонами (Amann et al., 1995). Возможность выявления указанных микроорганизмов классическими микробиологическими методами весьма ограничена, поскольку оптимальные условия их культивирования неизвестны. Также известно, что ряд микроорганизмов может вступать в некультивируемое состояние (Nagaraja, Titgemeyer, 2007). Поэтому молекулярно-биологические методы анализа, которые в настоящее время стали доступны исследователям, дают новый стимул в изучении микробиологических причин возникновения нарушения рубцового пищеварения.
Цель настоящего исследования состояла в изучении микробиома рубца высокопродуктивных коров и его связи с состоянием здоровья и продуктивности.
Материалы и методы
Эксперименты проводились в период 2007– 2020 гг., выполнен анализ содержимого рубца более 2 тысяч животных из хозяйств различных регионов России. Тотальную ДНК из исследуемых образцов содержимого рубца выделяли с использованием набора «Genomic DNA Purification Kit» (Fermentas Inc., Литва) согласно прилагаемой инструкции. Структуру микробного сообщества рубца определяли молекулярно-генетическими методами T-RFLP (Georgi et al., 2019), NGS, количество микроорганизмов – ПЦР в реальном времени (Brown et al., 2006). Математическую и статистическую обработки данных – с использованием программного обеспечения Excel и Past.
Результаты исследования
1. Молекулярно-генетический анализ микробиома рубца КРС
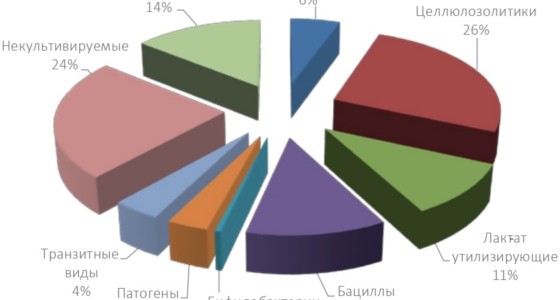
Рисунок 1
Среднее содержание микроорганизмов в рубце клинически здоровой коровы
На основе проведения молекулярно-генетических исследований установлено, что до 90% рубцовых микроорганизмов – некультивируемые и неизвестные ранее. При этом некультивируемые виды обнаружены и в числе известных таксонов – руминококков, эубактерий, клостридий, лактобактерий и др. Из рис. 1 видно, что основными обитателями микробиома рубца крупного рогатого скота оказались микроорганизмы, прямо или опосредованно связанные с процессами ферментации растительных кормов. Прежде всего это грибы-хитридиомицеты, которые являются основными инициатора- ми колонизации лигноцеллюлозных материалов, метаногенные археи, бактерии – амилолитики и целлюлозолитики (лахноспиры, руминококки и др.), лактат-утилизирующие бактерии, ферментирующие ряд кислот, включая молочную. При этом содержание в рубце микроорганизмов, расщепляющих растительные корма, уже к 2-3-месячному возрасту достигает уровня, характерного для взрослого животного.
Было установлено, что в течение суток содержание многих микроорганизмов в рубце КРС колеблется, что взаимосвязано с процессами рубцовой ферментации, в т. ч. образованием ЛЖК, аммиака и др.
Вопреки традиционным представлениям, у клинически здоровых животных в рубце помимо представителей нормальной микрофлоры выявлялись в небольших количествах возбудители различных заболеваний: энтеробактерии (способны вызывать гастроэнтерит), фузобактерии (некробактериоз), стафилококки и кампилобактерии (мастит), микоплазмы (микоплазмоз), пептококки (гнойно-некротические процессы), псевдомонады (гастроэнтериты), актиномицеты (актиномикозы) и другие. Это свидетельствует об их постоянном присутствии в рубцовой экосистеме клинически здоровых животных, не вызывающем при этом заболеваний.
Результаты молекулярно-генетических исследований, в отличие от традиционных высевов на питательные среды, позволили выявить статистически значимые различия в составе микробиома рубца между животными различного возраста, уровня продуктивности, состояния здоровья.
Полученные данные позволили впервые в мировой практике определить границы норм содержания в рубце различных микроорганизмов – представителей полезной, нежелательной и условно-патогенной микробиоты для определенного возраста и физиологического состояния животного. Сегодня эти нормы широко востребованы специалистами животноводческих хозяйств для оценки состояния микробиома рубца животных в стаде.
2. Особенности микробного и метаболического профиля рубца высокопродуктивных коров на фоне высококонцентратного кормления
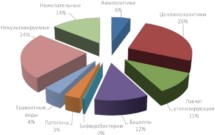
Результаты исследований показали, что микробиота рубца высокопродуктивных коров имеет значительные отличия (рис. 2). Так, продемонстрировано, что вместо ферментирующих клетчатку целлюлозолитиков в рубце высокоудойных коров начинают развиваться амилолитические бактероиды, особенностью метаболизма которых является разложение крахмала концентратов до молочной кислоты (лактата), что приводит к понижению рН рубцового содержимого. В результате угнетается рост и чувствительных к снижению рН лактат-утилизирующих бактерий. Однако такие условия оптимальны для развития продуцентов молочной кислоты лактобактерий и патогенов – фузобактерий, для которых лактат является питательным субстратом.
Рисунок 2.
Зависимость состава микробиома рубца и уровня молочной продуктивности коров

Таким образом, применяемые во многих высокопродуктивных хозяйствах высококонцентратные рационы, с одной стороны, обеспечивают максимальные удои за короткий промежуток времени, а с другой – наносят ущерб состоянию микробиома рубца.
Изучив состав микробиома рубца здоровых коров и коров, выбракованных по различным причинам (лактатный ацидоз, болезни репродуктивной системы, ламиниты), специалисты компании в результате исследования подтвердили, что у выбракованных коров выявляется нарушение состава микрофлоры рубца (рис. 3). Так, было продемонстрировано, что развитие лактатного ацидоза у коров было связано с нарушением баланса симбиотических микроорганизмов рубца, которое происходит при избыточном скармливании концентратов вместо объемистых кормов, как того требует генетический потенциал животных.
Рисунок 3.
Сравнение микрофлоры рубца здоровых и выбракованных коров
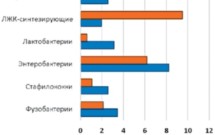
У выбракованных в связи с лактатным ацидозом коров по сравнению с клинически здоровыми животными наблюдались дисбиотические нарушения в составе микрофлоры рубца: начиналось развитие амилолитических бактерий филума Bacteroidestes, которые разлагают крахмал концентратов до лактата, снижающего рН рубцового содержимого (Russell, Hino, 1985). В результате угнетался рост чувствительных к снижению рН бактерий семейства Lachnospiraceae, синтезирующих целлюлазы, и лактат-утилизирующих бактерий Veillonellaceae, способных перерабатывать молочную кислоту в летучие жирные кислоты (Mackie, Heath, 1979).
Однако низкие значения кислотности оптимальны для развития продуцентов молочной кислоты лактобактерий семейства Lactobacillaceae, содержание которых у коров с лактатным ацидозом в нашем исследовании увеличивалось. При этом возрастало количество представителей семейства Fusobacteriaceae, поскольку лактат – питательный субстрат для развития данных микроорганизмов. Так, известно, что Fusobacterium necrophorum вызывают некробактериоз слизистой рубца, тканей копыт, поражение печени, эндометриты, а также маститы.
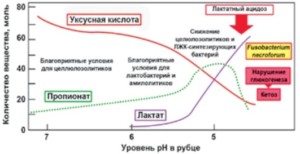
«Перекос» микрофлоры рубца в первую очередь отрицательно влияет на здоровье коров. Вследствие уменьшения доли целлюлозолитиков в рубце животное может частично или даже полностью потерять способность к усвоению растительной клетчатки кормов. При этом наблюдается изменение соотношения ЛЖК (уксусной, масляной и пропионовой кислот), что вызывает потерю продуктивности и снижение жирности молока. Изменение соотношения ЛЖК в рубце приводит к увеличению осмотического давления, что ингибирует потребление корма, выработку слюны, жвачку. Высокое осмотическое давление в рубце способствует переносу жидкости из крови в желудочно-кишечный тракт, что является причиной диареи и обезвоживания животного. Ранее Броун с соавторами (Brown et al., 2006) отмечали падение численности данных микроорганизмов при включении в рационы коров 70% и более концентратов.
Следовательно, нарушения метаболизма жвачных напрямую связаны с дисбиотическими сдвигами в составе микробиома рубца (рис. 4). Поскольку животное не синтезирует собственных ферментов целлюлаз, процессы переваривания клетчатки при нарушениях микробиома тормозятся. В результате гибели ЛЖК-синтезирующих микроорганизмов скорость образования пропионата в рубце снижается, вследствие чего процесс глюконеогенеза (образования глюкозы) у животных замедляется. Так, в норме у жвачных животных около 90% глюкозы образуется вследствие глюконеогенеза. Важнейшими предшественниками глюконеогенеза являются ЛЖК, образуемые в рубце и транспортируемые в печень, где они включаются в этот процесс, что обеспечивает животное высокоценной глюкозой. Смещение соотношения микроорганизмов в рубце может приводить к нарушению координации липидного обмена, что провоцирует возникновение кетоза.
Рисунок 4.
Изменения микробного и метаболического профиля рубца коров на фоне высококонцентратного кормления
Для исследования связи микробного и метаболического профиля рубца коров на фоне высоко- концентратного кормления применялся биоинформатический анализ потенциала метаболических возможностей с помощью программного пакета PicRust2 на основе данных 16S-метагеномики бактериального сообщества. Данный подход предоставляет возможность точно реконструировать метаболический потенциал бактерий и является более информативным по сравнению с анализом таксономической (видовой, родовой и пр.) принадлежности бактерий, поскольку пути метаболизма микробиома меняются в зависимости от таких факторов, как рацион, рН, а также вследствие быстрого обмена генетическим материалом между микроорганизмами.
Отмечено, что у животных с диагнозом «кетоз» был усилен уровень функционального потенциала 12 метаболических путей микробного сообщества рубца по сравнению с клинически здоровыми (рис. 5). Например, выяснилось, что в рубце коровы с кетозом происходила активация метаболических путей микробиома, связанных с гетероферментативным молочнокислым брожением и синтезом лактата. Это подтверждает каскадный механизм развития кетоза на фоне лактатного ацидоза рубца. Повышался также характерный для патогенов уровень метаболического потенциала, направленного на производство О-антигенов, которые связаны с противостоянием факторам иммунитета (фагоцитозу и литическому действию системы комплемента) хозяина. Это свидетельствует об усилении процесса патогенеза на фоне кетоза.
Рисунок 5.
Данные (р ≤ 0,05) функциональной аннотации метаболических путей метагеномного сообщества рубца коров
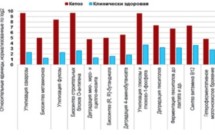
Таким образом, в организме коров на фоне дисбиозов и нарушения метаболизма микробиома рубца происходят серьезные сбои в углеводном, энергетическом, протеиновом, липидном обмене, что в конечном итоге приводит к возникновению целого спектра заболеваний, приобретающих массовый характер, и существенному снижению продолжительности жизни животных.
3. Связь микробиоты рубца со здоровьем высокопродуктивных животных
Было установлено, что снижение переваримости питательных веществ вследствие гибели целлюлозолитиков и колонизация рубца патогенами влекут за собой целый каскад нарушений: проблемы воспроизводства, заболевания конечностей, вымени, органов пищеварительной системы и др.
При нарушении баланса микробиоты в рубце происходит размножение патогенов, способных к колонизации и других локусов организма животных: вымени, репродуктивной системы, копыт.
Так, оказалось, что представители рубцовой микробиоты вовлечены в патогенез мастита и эндометритов.
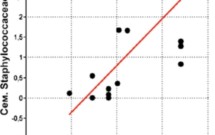
Известно, что типичные возбудители мастита включают Staphylococcus aureus, Streptococcus agalactiae, Corynebacterium bovis и Mycoplasma sp. Установлена четкая зависимость между увеличением содержания в рубце стафилококков, вызывающих мастит, и ростом содержания соматических клеток в молоке (рис. 6).
Рисунок 6.
Зависимость между содержанием стафилококков в рубце и соматических клеток в молоке коров
Зарубежными исследователями показано, что не только сама микрофлора, но и ее метаболиты, а также компоненты клеточных стенок участвуют в развитии мастита. Так, липополисахариды клеточных стенок грамотрицательных бактерий способны повреждать эпителий рубца, попадая в кровь, и, далее, нарушая проницаемость гемато-молочного барьера, проникать в молочные железы, приводя к их воспалению. В свою очередь, некоторые короткоцепочечные жирные кислоты, которые вырабатываются рубцовой нормобиотой в качестве продуктов ферментации, оказывают на вымя противовоспалительное действие.
Оказалось также, что проблемы воспроизводства, в числе которых послеотельные эндометриты, также взаимосвязаны с состоянием рубцовой микрофлоры. Ведущая роль в этиологии послеотельного эндометрита у коров принадлежит ассоциации четырех микроорганизмов: бактероидов, фузобактерий, E. coli и актиномицетов, действующих в синергизме.
Были получены интересные данные, свидетельствующие о том, что введение в рацион новотельных коров фитопробиотика позволяло скорректировать микробиоценоз половых путей, значительно снижая присутствие микроорганизмов, связанных с возникновением эндометрита: фузобактерий, энтеробактерий, бактероидов и актиномицетов, – по сравнению с контрольной группой коров без препарата. Важно, что и симптомов эндометрита у коров опытной группы в конце послеотельного периода зарегистрировано не было.
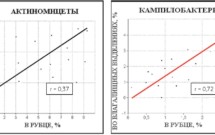
Полученные данные зависимости микрофлоры половых путей от состава микрофлоры рубца подтверждались расчетом корреляций Пирсона (рис. 7). По результатам молекулярно-биологического метода T-RFLP-анализ увеличение содержания некоторых групп бактерий, таких как актиномицеты и кампилобактерии, в рубце было связано с возрастанием данных микроорганизмов (r = 0,37, r = 0,72 соответственно) во влагалищных выделениях коров.
Рисунок 7.
Зависимость между содержанием бактерий в рубце и половых путях новотельных коров
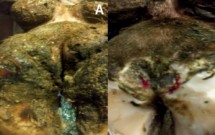
Аналогичные результаты были получены и при исследовании микрофлоры соскобов с копыт. У коров, в рубце которых были отмечены дисбиотические нарушения: низкое содержание целлюлозолитиков и лактат-продуцирующих микроорганизмов и высокое содержание бактероидов, – были отмечены поражения копыт: подошвенная язва (рис. 8А) и межпальцевый дерматит (рис. 8Б). Как в рубце, так и в соскобах с копыт обнаруживали повышенное содержание условно-патогенных и патогенных фузобактерий, энтеробактерий и актиномицетов.
Рисунок 8.
Поражение копыт КРС: А – подошвенная язва, Б – межпальцевый дерматит
Полученные закономерности свидетельствуют о том, что при снижении резистентности макроорганизма (в т. ч. при лактатном ацидозе) наблюдается отклонение условий в рубце от оптимальных (изменение рН, температуры, осмотического давления, уровня ЛЖК). Это приводит к нарушению состава рубцовой нормофлоры и сопровождается активным размножением патогенов в рубце и других биотопах организма животного, что может провоцировать развитие многих экономически значимых заболеваний.
Выводы
Наши исследования позволили подтвердить, насколько значительны различия бактериального сообщества рубца клинически здоровых коров и выбракованных в связи с лактатным ацидозом: доля полезной микрофлоры при ацидозе снижается, а патогенной – возрастает. Можно сделать вывод, что в результате нарушений микробиома рубца происходит ухудшение здоровья и снижение срока продуктивного использования. Исследования в данном направлении имеют не только фундаментальное, но и практическое значение, поскольку проблема лактатного ацидоза коров с каждым годом становится все более острой в Российской Федерации, особенно в Ленинградской области, в связи с возникновением на многих молочных фермах проблем со здоровьем, падением молочной продуктивности и снижением продуктивного долголетия коров.
Литература
- Van Soest P.J. Nutritional ecology of the ruminant. 2nd edn. Cornell University Press, Ithaca, New, 1994.
- Amann R.I., Ludwig W., Schleifer K.H. Phylogenetic identification and in situ detection of individual microbial cells without cultivation // Microbiol. Rev. – 1995. – V. 59. – P. 143–169.
- Nagaraja T.G., Titgemeyer E.C. Ruminal acidosia in beef cattle: The current microbiological and nutritional outlook // Journal of Dairy Science. – 2007. – Vol. 90. – P. 17–38.
- Brown M.S., Ponce C.H., Pulikanti R. Adaptation of beef cattle to high-concentrate diets: performance and ruminal metabolism // J. Anim Sci. – 2006. – V. 84. – P. 25–33.
- Georgi Yu. Laptev. Valentina A. Filippova. Ivan I. Kochish. Elena A. Yildirim. Larisa A. Ilina. Andrei V. Dubrovin. Evgeni A. Brazhnik. Natalia I. Novikova. Oksana B. Novikova. Margarita E. Dmitrieva. Vladimir I. Smolensky. Peter F. Surai. Darren K. Griffin and Michael N. Romanov. Examination of the Expression of Immunity Genes and Bacterial Profiles in the Caecum of Growing Chickens Infected with Salmonella Enteritidis and Fed a Phytobiotic / Animals. – 2019. – 9(9). 615. doi:10.3390/ani9090615.
- Russell J. B., Hino T. Regulation of lactate production in Streptococcus bovis: A spiraling effect that contributes to rumen acidosis // J. Dairy Sci. – 1985. – V. 68. – P. 1712–1721.
- Mackie R.I., White B.A. Symposium: Rumen microbial ecology and nutrition: Potencial impact on nutrient output // J. Dairy Sci. 1979. – V. 73. – P. 2971–2995.
Авторы:
Владислав Николаевич Большаков, Елена Германовна Дубровина, Лариса Александровна Ильина, Елена Александровна Йылдырым, Георгий Юрьевич Лаптев, Валентина Александровна Филиппова, ООО «БИОТРОФ», г. Санкт-Петербург