Введение
Актинобациллезная плевропневмония (АПП) – болезнь свиней, вызываемая микроорганизмом Actinobacillus pleuropneumoniae. На начало 2021 года было известно 18 серотипов (сероваров) этого микроорганизма i. В апреле 2021 года на основании результатов секвенирования генома предложено выделить ранее нетипируемые изоляты Actinobacillus pleuropneumoniae в новый 19-й серотипii.
Клинически болезнь (АПП) характеризуется воспалением легочных тканей (пневмонией, плевропневмонией) преимущественно в диафрагмальных долях легкихiii. Клинические признаки поражения респираторной системы могут наблюдаться уже через несколько часов после инфицированияiv. Чаще всего подобное течение болезни отмечается при инфицировании неиммунных («чистых») животных. Инфицирование неиммунных животных микроорганизмом Actinobacillus pleuropneumoniae, особенно в условиях стресса (теплового, транспортного, технологического и др.), вызывает молниеносную острую или подострую форму течения болезни.
Напротив, в энзоотически1
неблагополучном ста- де у свиней может присутствовать скрытое хроническое течение или просто носительство возбуди- теля без явных клинических признаков (болезни).
Тяжесть течения болезни, а соответственно, и экономические потери предприятия зависят от многих
факторов: состояния животных и условий их содержания, вирулентности серотипа/штамма микроорганизма, наличия сопутствующих инфекций и др.
В неблагополучном стаде микроорганизм A. pleuropneumoniae присутствует на миндалинах 100% свиноматок. Инфицирование поросят возможно уже в ранний период жизни (до отъема), однако пассивный (колостральный) иммунитет сдерживает клиническое проявление болезни. Раннее (до 50–60 д. ж.) проявление АПП исключительно редкое явление. После естественного снижения уровней колострального иммунитета значительно повышается доля свиней-носителей A. pleuropneumoniaev. Однако максимальный охват поголовья и клиническое проявление АПП наблюдается у свиней в возрасте ~ 100–140 д. ж.
При данной инфекции экономические потери складываются из прямых потерь (гибель/выбраковка животных, снижение среднесуточного прироста ЖМ (ССП), ухудшение конверсии кормов, увеличение периода откорма) и опосредованных затрат (лечение/профилактика и др.). Значения экономических потерь индивидуальны для каждого хозяйства/фермы и затруднительны для точной оценки ввиду вышеупомянутых факторов. Тем не менее результаты анализа, опубликованные зарубежными специалистами, указывают, что при циркуляции в стаде микроорганизма Actinobacillus pleuropneumoniae производители свинины в среднем теряют 6,4 € на каждую откормочную свиньюvi. Австралийские специалисты оценивают потери в 64 $ в год на каждую свиноматку, без учета затрат на медикаментыvii.
Диагностика
Диагностический процесс – важнейший элемент системы ветеринарных мероприятий, и без его правильной реализации невозможно сформировать эффективную схему лечебно-профилактиче- ских мероприятий. Правильная диагностика АПП (Actinobacillus pleuropneumoniae) и оценка ущерба, наносимого этой болезнью, должны включать комплексный анализ всей доступной информации:
1. Клиническое обследование: проявление признаков, характерных для патологий респираторной системы: апатия, отказ от корма, кашель, брюшной тип дыхания, истечения из носовых отверстий, повышенная температура тела.
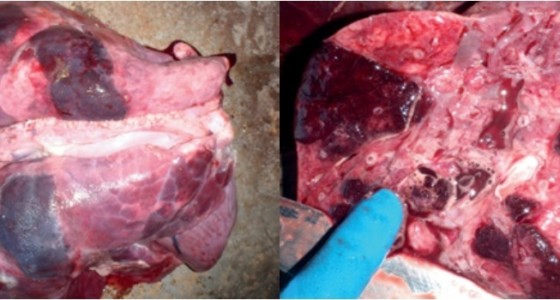
2. Патолого-анатомическое обследование: выявление характерных поражений (геморрагически-некротических очагов, плевропневмонии
и плевритов), преимущественно в дорсо-каудальных областях легких (фото 1).
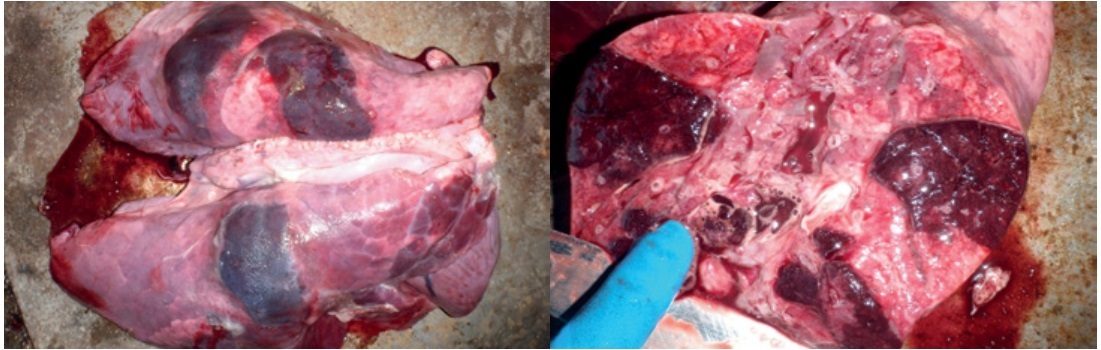
Фото 1.
Результат инфицирования свиньи микроорганизмом Actinobacillus pleuropneumoniae: геморрагически-некротические очаги воспаления в легких
3. Обследование на убойном пункте (методика
CLP2): система оценки легких на убойном пункте является элементом диагностики/контроля актинобациллезной плевропневмонии (АПП) и энзоотической пневмонии (M. hyo) свиней. Методика позволяет объективно оценивать ситуацию по респираторным патологиям в хозяйстве/ ферме и анализировать результативность проведенных ветеринарно-профилактических мероприятий.
4. Серологические исследования: выявление антител в сыворотках крови важно для понимания динамики эпизоотического процесса и эффективного контроля болезниviii. Особенности анализа и интерпретации:
• Оценка инфекционного процесса (выявление антител против всех серотипов): все известные серотипы микроорганизма Actinobacillus pleuropneumoniae выделяют токсин APX IV. Этот токсин обнаруживается только у инфицированных животных. В ответ организм животного вырабатывает специфические антитела против токсина APX IV. Выявление (в сыворотках крови животных) специфических антител против токсина APX IV позволяет утверждать, что обследованные животные в прошлом контактировали с микроорганизмом Actinobacillus pleuropneumoniae в интервале от 3-4 недель до 3-4 месяцев.
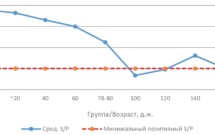
• Серопрофиль стада: отражает основную тенденцию развития эпизоотического процесса. Формируется на основании обследования свиней различных групп возрастов: свиноматки, свиньи 20, 40, 60, 80, 100, 120, 140, 160, 180 д. ж. (диаг. 1). Детальный анализ результатов позволяет оценить однородность иммунного статуса и определить период массового инфицирования стада.
Диаграмма 1.
Актинобациллезная плевропневмония свиней (AПП): динамика специфических антител против токсина APX IV у свиней разных возрастов, «иммунный провал» ~ 90–110 д. ж.
• Оценка поствакцинальных антител: неинформативна. После иммунизации любой вакциной против АПП антитела к токсину APX IV не образуются, т. к. этот анатоксин (инактивированный токсин, токсоид) не входит в состав вакцинix. Выявление антител против токсина APX IV не позволяет делать объективные выводы об иммунном статусе животного.
• Серотипировние (выявление антител против отдельных серотипов): не имеет практической ценности с учетом одновременной циркуляции в стадах большого количества разных серотипов Actinobacillus pleuropneumoniae.
5. Микробиологические исследования: в биологическом материале (мазки/смывы со слизистой носоглотки и миндалин, ткани легкого
• выделение циркулирующего микроорганизма;
• определение чувствительности к различным антибиотикам.
6. Молекулярно-биологические исследования: выявление специфических фрагментов генома Actinobacillus pleuropneumoniae в биологическом материале (мазки/смывы со слизистой носоглотки и миндалин, ткани легкого).
ВНИМАНИЕ: любые лабораторные исследования имеют множество ограничений, и специалист не имеет права ставить диагноз исключительно на основании результата единичного исследования!
Профилактика и контроль
Основой эффективного контроля любого инфекционного процесса в стаде является разрыв «эпизоотической цепи», т. е. предотвращение контакта источника инфекции и восприимчивого животного. Положительный результат может быть достигнут только при комплексном подходе с применением технологических, зоотехнических и ветеринарных мероприятий. Например, несоблюдение базового принципа «пусто-занято», смешивание свиней с разными параметрами (возраст, вес, иммунный статус и т. п.) повышает проблематику АПП в стадеx.
Ветеринарные мероприятия включают:
• профилактическую иммунизацию;
• лечебно-профилактические антибактериальные обработки;
• поддерживающую терапию (витамины, НПВС, др.).
Вакцинация
Правильно реализованная вакцинация (схема, вакцина) минимизирует клинические проявления АПП, смертность и поражения легочных тканейxi. Важнейшим фактором эффективной защиты популяции (группы, стада) является однородность иммунного статуса всех животных.
Период (возраст) вакцинации оказывает сильное влияние на развитие активного иммунитета, клиническое проявление болезни, снижение производственных показателей и, как итог, экономические потери. При выборе периодов вакцинации также рекомендуется учитывать эпизоотическую ситуацию в стаде/группе по другим инфекциям, особенно вызывающим иммуносупрессию: РРСС, ЦВС-2, БА, грипп и др.
Базовые рекомендации по иммунизации свиней против всех серотипов микроорганизма A. pleuropneumoniae3:
Ремонтный молодняк: рекомендуется двукратная вакцинация (с интервалом 3-4 недели) до контакта с основным стадом.
Основное стадо (свиноматки): вакцинация в большинстве случаев не требуется в связи с достаточным естественным иммунитетом свиноматок против A. pleuropneumoniae. Возможна при выявлении высокой разнородности иммунного статуса.
Поросята доращивания (~ 20–80 д. ж.): в этот период защиту поросят от A. pleuropneumoniae обеспечивает пассивный (колостральный) иммунитет, полученный от свиноматок. Продолжительность колострального иммунитета в среднем составляет 8–12 недель, однако может сильно варьировать в зависимости от множества факторов. В этот период иммунная система поросят начинает формирование собственного (активного) иммунитета, который предотвращает клиническую болезнь в старшем возрасте (> 80 д. ж.). Выбор оптимального возраста иммунизации поросят очень важен как минимум по двум причинам:
• ранняя иммунизация поросят на фоне высоких уровней колостральных антител приводит к частичной инактивации вакцины и слабому поствакцинальному иммунитетуxii;
• поздняя иммунизация поросят вероятна на фоне инкубационного периода болезни и может даже осложнить эпизоотическую ситуацию в стаде.
Свиньи откорма (80–180 д. ж.): высокий и однородный иммунный статус у свиней группы откорма достигается своевременной вакцинацией в период доращивания, когда колостральный иммунитет снизился, но еще обеспечивает защиту.
Антибактериальные обработки
Большинство полевых изолятов A. pleuropneumoniae чувствительны к широкому спектру антибактериальных средств (амоксициллин, тиамулин, тетрациклины, флорфеникол, тилмикозин и др.). Лечебно-профилактическое применение антибиотиков обосновано и экономически оправданно, особенно в условиях активной циркуляции других бактериальных агентов (Str. suis, H. parasuis, P. multocida и др.). Однако следует помнить, что подобные обработки не могут обеспечить длительную защиту и полное удаление микроорганизма из тканей миндалин инфицированного животного-переносчикаxiii, а также предотвратить выделение Actinobacillus pleuropneumoniae в окружающую среду.
На локальном уровне (в хозяйстве/ферме) следует учитывать возможность формирования резистентности бактерий к применяемым антибиотикам. Причины этого явления банальны: несоблюдение дозировок и курса обработок, плохая практическая реализация обработок, качество препаратов (несоответствие заявленных показателей, плохая растворимость, нестабильность ДВ и др.). Именно поэтому настоятельно рекомендуется контролировать эффективность антибактериальных препаратов для целевого микроорганизма посредством лабораторного (бактериологического) исследования.
Для решения проблематики антибактериальной резистентности применяются различные подходы: разделение применяемых антибиотиков по периодам возрастам, ротация (замена) применяемых действующих веществ (ДВ), применение препаратов, включающих несколько ДВ и др. Исследования по сравнению эффективности различных комбинаций антибактериальных препаратов, проведенные несколькими компаниями и научными организациями (Provimi-México, INIFAP4, FMVZ5, UNAM6, Zoetis), показали, что комбинация тиамулин + хлортетрациклин7 является лучшим вариантом для контроля бактерий, вызывающих респираторные патологии у свинейxiv.
Выводы и заключения
- Актинобациллезная плевропневмония (АПП), вызываемая микроорганизмом Actinobacillus pleuropneumoniae, широко распространена во всем мире и по-прежнему актуальна для промышленных свиноводческих предприятий.
- Разнообразие серотипов Actinobacillus pleuropneumoniae, одновременно циркулирующих в стадах свиней, осложняет диагностику и профилактику болезни.
- Диагностика и оценка ущерба от болезни (АПП) должна проводиться комплексно, с анализом всей доступной информации и методов.
- Эффективная профилактика и контроль АПП должны включать технологические, зоотехнические и ветеринарные мероприятия.
- Схема ветеринарных мероприятий (вакцинации, обработки) должна формироваться на основа- нии результатов диагностики с учетом текущей ситуации и динамики эпизоотического процесса.
Ссылки:
- Энзоотия – вспышка болезни животных, привязанная к определенной местности.
- CLP (англ. Ceva Lung Program) – методика оценки тяжести и распространенности поражений, ассоциируемых с Mycoplasma hyopneumoniae и Actinobacillus pleuropneumoniae.
- КОГЛАПИКС® – инактивированная бактерин-токсоидная вакцина против актинобациллезной плевропневмонии свиней, вызванной всеми известными серотипами Actinobacillus pleuropneumoniae.
- INIFAP – Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias.
- FMVZ – Facultad de Medicina Veterinaria y Zootecnia.
- UNAM – Universidad Nacional Autónoma de México.
- ТИАКЛОР® – гранулированный термостабильный порошок тиамулина 5% и хлортетрациклина 20% для перорального применения.
Литература:
i Bosse JT, Li Y, Sarkozi R, Fodor L, Lacouture S, Gottschalk M, Casas Amoribieta M, Angen O, Nedbalcova K, Holden MTG, Maskell DJ (2018) Proposal of serovars 17 and 18 of Actinobacillus pleuropneumoniae based on serological and genotypic analysis. Vet Microbiol 217:1–6.
ii Stringer OW, Bossé JT, Lacouture S, Gottschalk M, Fodor L, Angen Ø, Velazquez E, Penny P, Lei L, Langford PR, Li Y. Proposal of Actinobacillus pleuropneumoniae serovar 19, and reformulation of previous multiplex PCRs for capsule-specific typing of all known serovars. Vet Microbiol. 2021 Apr;255:109021. doi: 10.1016/j. vetmic.2021.109021. Epub 2021 Feb 24. PMID: 33667982.
iii Bosse J.T., Janson H., Sheehan B.J., Beddek A.J., Rycroft A.N., Kroll J.S., Langford P.R., Actinobacillus pleuropneumoniae: pathobiology and pathogenesis of infection, Microbes Infect. (2002) 4:225–235[PubMed]
iv Baarsch M.J., Foss D.L., Murtaugh M.P., Pathophysiologic correlates of acute porcine pleuropneumonia,Am. J. Vet. Res. (2000) 61:684–690 [PubMed]
v Vigre H Angen O Barfod K Lavritsen DT Sorensen V. Transmission of Actinobacillus pleuropneumoniae in pigs under field-like conditions: emphasis on tonsillar colonisation and passively acquired colostral antibodies. Veterinary Microbiology, 89, 151-159, 2002.
vi https://www.daf.qld.gov.au/animal-industries/pigs/pig-health-and-diseases/a-z-pig-diseases/pleuropneumonia-in-pigs
vii https://www.daf.qld.gov.au/animal-industries/pigs/pig-health-and-diseases/a-z-pig-diseases/pleuropneumonia-in-pigs
viii M. Rodrigues Da Costa, P. López-Colom, J. Borobia-Belsue, E.G. Manzanilla; WHY VACCINATION TIMING MATTERS: A CASE STUDY ON THE IMPORTANCE OF VACCINATION AGE AND DIFFERENT PRODUCTION FLOWS TO CONTROL ACTINOBACILLUS PLEUROPNEUMONIAE ON A FARROW-TO-FINISH FARM; 12th European Symposium of Porcine Health Management (ESPHM 2021), 14-16/04/21 RES-OP-05.
ix Кукушкин С.А., д. в. н., Методы оценки эффективности вакцинации свиней против респираторных болезней, http://www.piginfo.ru/company_page/?company_id=29680&view=news&id=29945
x K. Koenders – Van Gog, E. Rooijakkers, T. Van Horrik, T. Tobias 3;MANAGEMENT MATTERS; ASSOCIATIONS BETWEEN APP ANTIBODY RESPONSE AND ANIMAL FLOW MEASURES 12th European Symposium of Porcine Health Management (ESPHM 2021), 14-16/04/21 FTP-OP-11.
xi Juan M.Palacios, Ruben Pacheco, Susana Mendoza; Pleurisy evaluation in slaughtered pigs and it´s effect on the average daily weight gain in batches with/without an Actinobacillus pleuropneumoniae vaccines, International Pig Veterinary Society Congress 2020, RIO DE JANEIRO5-6/11/2020.
xii Krejci J, Nechvatalova K, Kudlackova H, Faldyna M, Kucerova Z, Toman M. Systemic and local antibody responses after experimental infection with Actinobacillus pleuropneumoniae in piglets with passive or active immunity. J Vet Med B Infect Dis Vet Public Health. 2005 May;52(4):190-6. doi: 10.1111/j.1439-0450.2005.00844.x. PMID: 16000115.
xiii N. Fittipaldi, C. Klopfenstein, M. Gottschalk, A. Broes, M.A. Paradis, and C.P. Dick Assessment of the efficacy of tilmicosin phosphate to eliminate Actinobacillus pleuropneumoniae from carrier pigs Can J Vet Res. 2005 Apr; 69(2): 146–150.
xiv A. Raúl González M., Álvaro Rojo G1., Luis Gómez N., Jazmín De la Luz2, Catalina Tufiño L., Rene Segura3, Héctor Pérez L, Ivan Sanchez B., José Francisco Rivera-Benítez; Evaluation of the effectiveness of antibiotics combination for the control of porcine respiratory complex (PRC) pathogens in an experimental challenge; International Pig Veterinary Society Congress 2020, RIO DE JANEIRO5-6/11/2020.
Автор: Владимир Владимирович Пругло, к. в. н., руководитель отдела ветеринарного сервиса ООО Сева СА, член экспертно-консультационного совета по ветеринарии НСС