Уважаемые читатели! Мы продолжаем публиковать статьи, посвященные РРСС. Эта статья передана в нашу редакцию специалистами холдинга Черкизово. Она опубликована в журнале Viruses. Схемы и таблицы, на которые ссылаются авторы, просьба смотреть в оригинале статьи, который можно скачать здесь.
Авторы:
Karyn Havas1, Dennis Makau2, Kim VanderWaal2, Gordon Spronk1, Brad Heron3, Scott Dee1, Andres Perez2
1 Pipestone Research, Pipestone Holdings, Pipestone, Minnesota, 56164
2 Факультет ветеринарии, Колледж Ветеринарии Университета Миннесота, Сэнт-Пол, Миннесота 55108
3 ООО «Черкизово-Свиноводство», Липецк, Россия
Благодарим Кукушкина С. А. за предоставленные фотографии.
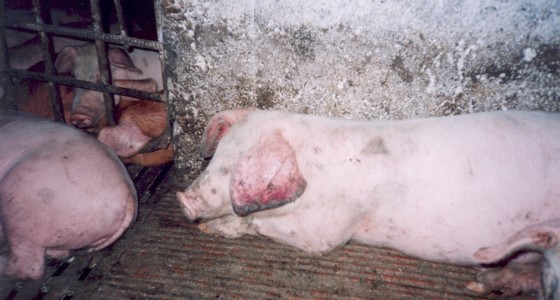
На фото сверху: Поросята группы доращивания, больные РРСС (угнетение, цианоз кожи ушей, отставание в росте)
Этическое заявление
Авторы подтверждают, что этические политики журнала, изложенные в руководстве автора журнала, были соблюдены. Это исследование не требует какого-либо этического одобрения, поскольку данные были результатом полевых наблюдений, полученных в результате вспышки заболевания, а не от запланированной конструкции исследования.
Общие положения
Репродуктивно-респираторный синдром свиней (РРСС) является экономически важным заболеванием свиней во многих частях мира. Вирус репродуктивно-респираторного синдрома свиней (РРСС) типа 1 является эндемичным в Европе, и превалентность подтипов разнится территориально. В этом исследовании мы изучали тяжёлую вспышку РРСС, зарегистрированную на 30 фермах, расположенных в восточной части России и принадлежащих крупной свиноводческой компании в данном регионе. Данные включали в себя 28 сиквенсов ORF5 с 27 ферм, результаты полимеразной цепной реакции (ПЦР), которая была частью диагностических исследований, отчёты о клинических признаках и записи о перемещении животных. Наблюдения показали, что вспышка произошла из-за двух чётких вариантов дикого типа РРСС 1 подтипа 1 со средним генетическим расстоянием, составлявшим 15 %. Результаты показывают, что эти варианты вируса РРСС появились в регионе относительно недавно, в 2018 – 2019 годах, перед тем, как заразить предприятие. Клинические признаки не отличались в зависимости от вариантов, но они варьировались в зависимости от стадии производства. Отклонения в биобезопасности, включая перемещение животных с заражённых ферм, также привели к распространению заболевания.
Введение
Вирус репродуктивно-респираторного синдрома свиней (РРСС) был изолирован в начале 1990-х (Terpstra et al., 1991; G. Wensvoort et al., 1991). Связанное с ним заболевание, репродуктивно-респираторный синдром свиней (РРСС), является экономически важной болезнью, которая приводит к абортам супоросных свиней (свиноматок) и поросят всех возрастов. Клиническая картина РРСС и в Европе, и в Северной Америке включает в себя аборты супоросных свиноматок, мумифицированные плоды, мертворождённых поросят и слабое потомство, а также молодых поросят, страдающих респираторными заболеваниями (Cromwijk, 1991; Hill, 1990). Вирус РРСС был первоначально классифицирован в Североамериканский и Европейский генотипы (Murtaugh et al., 1995), а сейчас классифицируется как Betaarterivirus suid 2 (РРСС2) и Betaarterivirus suid 1 (РРСС1), соответственно (“Международный комитет по таксономии вирусов, девятый отчёт по классификации вирусов и номенклатуре таксонов”, 2011).
Мертворождение – характерный признак при РРСС. Фото Кукушкина С. А.
Существует дальнейшее генетическое подтипирование среди РРСС1 в Восточной Европе и России. Подтип 1 (РРСС1-1) наиболее близок к вакцинному штамму Лилестад и вызывает лёгкое клиническое заболевание (Morgan et al., 2013). В свою очередь, вирусные варианты в подтипе 2 (РРСС1-2) вызывают клиническое заболевание средней и высокой тяжести, например, в опыте с трехнедельными поросятами все заражённые поросята пали, а контрольная группа – нет. (Yuzhakov et al., 2017). Другие опыты оценивали подтип 3 (РРСС1-3) по сравнению с подтипом 1 (РРСС1-1), и показали, что РРСС1-3 является более патогенным на основе клинической оценки и сравнении иммунного ответа (Morgan et al., 2013). В России в дополнение к инфекциям РРСС1 и РРСС2 (Raev et al., 2020), также были обнаружены нетипичные сиквенсы вируса РРСС, которые являлись комбинациями РРСС1 и РРСС2 (Yuzhakov et al., 2017). Недавнее исследование нетипичных сиквенсов РРСС показало наличие лёгкого заболевания, при котором у поросят было небольшое увеличение температуры тела, одышка и потеря аппетита, за которым последовало клиническое восстановление, несмотря на признаки пневмонии на вскрытии. (Yuzhakov et al. 2020).
Весной 2020 года тяжёлая вспышка РРСС случилась на свиноводческой ферме, принадлежащей ООО Черкизово. Несмотря на вспышку РРСС, ООО Черкизово было 4-ой по величине свиноводческой компанией в России в 2020 году. В 2019 году их выручка составила 24.5 миллиарда рублей ($334 миллиона), а в 2020, несмотря на вспышку, выручка составила 26.5 миллиарда рублей ($362 миллиона). Для того, чтобы достичь такой прибыли, они продали 284,167 и 301,547 тонны свинины в 2019 и 2020 годах соответственно (информация получена от Брэда Хирона, директора по производству, ООО «Черкизово»).
Компания «Черкизово» использует производственную модель с несколькими площадками. (Harris DL, 2020). Регионы России, в которых были расположены инфицированные площадки, в основном находились на юго-востоке Московской области, один регион находится на границе с Украиной (таблица 1). Ферма использовала модифицированную живую вакцину против европейского штамма РРСС. На ферме также циркулировала болезнь Ауески. Площадка откорма, расположенная в Тамбовской области, была первой, на которой диагностировали РРСС в марте 2020 года. В апреле РРСС был также подтверждён на площадке в Тамбовской и Воронежской областях. В Воронеже основная часть заболевших пришлась на апрель-май. Вспышка потом была обнаружена и в Липецкой области, а осенью – появилась и в Пензенской области (информация от директора по производству заражённой фермы, февраль 2021 г.).
Перемещения свиней происходили регулярно по всему холдингу и между регионами в рамках нормального производственного процесса. В Воронеже была площадка-мультипликатор, с которой отправляли ремсвинок на площадки развития ремсвинок в другие регионы. Площадка получила партию ремсвинок, которые были импортированы в Россию и откарантинированы в Липецком регионе. После окончания карантина ремсвинки были отправлены в Воронежскую область и имели отрицательные тесты по РРСС, затем через 5 дней у них был сомнительный результат, и после этого у них были положительные тесты по РРСС. Это было единственное перемещение свиней между регионами. Во время вспышки свиньи были перемещены с ферм в Воронежской области в Липецк и Тамбов (информация от директора по производству заражённой фермы, февраль 2021 г.). Перемещение свиней осуществлялось товарным скотовозом с прицепом, закреплённым за отдельными площадками. Предположение, что персонал перенес вирус, не выдвигалось, так как было очень мало персонала, который работал между регионами (информация от директора по производству заражённой фермы).
Исследование отражает перемещение вируса РРСС внутри свиноводческого холдинга, в котором была длительная вспышка РРСС, и описывает генетическое разнообразие, обнаруженное внутри холдинга. Методы и результаты, продемонстрированные здесь, иллюстрируют использование новых филогенетических инструментов для поддержания изучения вспышки в интенсивных свиноводческих фермах и иллюстрирует модели распространения вируса РРСС в свиноводческих предприятиях.
Методы
Данные

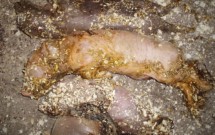
Рождение нежизнеспособных поросят, погибающих в первые 2-3 суток после рождения при РРСС. Фото Кукушкина С. А.
Пострадавшая компания с заражёнными поросятами предоставила данные по перемещению поросят, диагностике и клиническим признакам, собранные по группе из 30 площадок в их свиноводческом холдинге, по 27 площадкам были предоставлены 28 сиквенсов по открытой рамке чтения 5 (ORF5) в пробах на вирус РРСС с этих площадок. Данные по клинике и диагностике отобраны с производственных площадок, классифицированных как: участок подсоса, участок доращивания, участок откорма, КУДО. Полимеразная цепная реакция (ПЦР) и результаты секвенирования по вирусу РРСС были использованы для дифференциальной диагностики по таким заболеваниям, как болезнь Ауески (БА). Клинические данные включали в себя клинические признаки, информацию по падежу, тип производственной площадки и даты заявок в лабораторию. Данные по перемещению свиней включали в себя площадки-отправители и принимающие площадки, а также недели перемещения. Клинические данные не были стандартизированы по площадкам, так как некоторые площадки отчитывались о специфичных клинических признаках, а другие – просто сообщали, что есть клинические признаки. Данные по падежу были классифицированы сотрудниками площадок на три категории: нормальный падёж, повышенный падёж и массовый падёж. Свиноводческие фермы имеют определённый уровень постоянного падежа, который считается нормальным, увеличения относительно этого уровня были зарегистрированы вхолдинге и были разделены на «увеличенный падёж» и «падёж», а также «массовый падёж», при котором большое количество поросят погибают в течение короткого периода времени.
Анализ секвенирования:
Всего для анализа было предоставлено 28 сиквенсов, изолированных из 27 площадок. Дополнительно 100 сиквенсов были получены из GenBank с использованием BLASTn, также была проведена очистка данных, чтобы удалить дублирующиеся сиквенсы (сиквенсы, которые были идентичны на 100% хотя бы с одним из других сиквенсов, по которым имелись ранние сиквенсы). После этого шага по очистке данных 91 сиквенс из GenBank были включены в анализ. Сиквенсы GenBank были скомбинированы с 28 сиквенсами вспышек, а также сиквенс вакцины Лилестад был включен в список, таким образом, 120 сиквенсов были использованы для последующего анализа. Выравнивание нескольких сиквенсов было произведено с помощью алгоритма MUSCLE в ALiView с использованием настроек по умолчанию (Larsson, 2014). Определение рекомбинаций было произведено с помощью программы детекции рекомбинаций (RPD v 4.1) (Martin et al., 2015) и потенциально рекомбинатные сиквенсы были исключены из опыта. Первоначальная древовидная топологическая схема была оценена с помощью MEGA X, чтобы построить максимально схожее филогенетическое древо (используя модель GTR гамма распределения (GTR+ Γ) и 100 бутстрепов, и оценить молекулярный сигнал с помощью TempEst (v 1.5.3) (Rambaut et al., 2016).
Мы соответственно скомбинировали баесовскую Skygrid соединительную модель (Gill et al., 2013), GTR и дискретное гамма-распределение (GTR+Γ) (Felsenstein, 1981; Tavare, 1986), и несвязанную логнормальную модель молекулярных часов в баесовском эволюционном анализе по модельным древам (BEAST) (v1.10.4) (Suchard et al., 2018) на XSEDE на CIPRES Cyberinfrastructure для филогенетического исследования (Miller et al., 2010) для реконструкции вирусной популяционной динамики. Мы использовали 500 миллионов баесовских цепей Монте-Карло Маркова (MCMC) цикличных отборов проб каждую 50,000ую позицию для достижения достаточного размера пробы. Мы использовали (v 1.7.1) (Rambaut et al., 2018) для оценки модельной конвергенции. Конвергенция была оценена, исключая 10 % цепи максимальной вероятности филогенетической ветви (клада) в качестве прожига для гарантии эффективного размера пробы (ESS) как минимум 200. Затем было сгенерировано филогенетическое дерево максимальной вероятности, для визуализации был использован набор ggtree в R (Yu, 2020). Наивысшая апостериорная плотность (HPD) узлов в филогенетических ветвях, к которым принадлежал изучаемый сиквенс, была использована для вычисления времени отклонения ветвей от их предшественников.
Статистический анализ и картография:
Для клинических и диагностических данных сравнивались и высчитывались частота и процентное соотношение внутри категорий с использованием точного теста Fisher. Уровень значимости был выставлен на 0.05. Принимая во внимание то, что БА была на ферме, когда произошла вспышка РРСС, была также проведена оценка связи между инфекцией БА и клиническим заболеванием РРСС.
Google карты (таблица 1) и QGIS 3.10 с ESRI® (таблицы 4 и 5) были использованы для визуализации пространственно-временных отношений между площадкам и их статусом инфекции (команда развития QGIS, 2021. QGIS географическая информационная система. Открытый Геопространственный Проект. http://qgis.osgeo.org). Статус инфекции был определен с помощью ПЦР для обнаружения нуклеиновой кислоты вируса РРСС, а также через секвенирование. Сиквенсы от образцов, положительных по нуклеиновой кислоте вируса РРСС, были классифицированы как «инфицированный неизвестный» (несеквенированный), «инфицированный вариантом клада 1», «инфицированный вариантом клада 2», «инфицированный вариантом клада 3», или «неинфицированный».
Результаты
Результаты секвенирования
28 сиквенсов РРСС, полученных от положительных проб на вирус РРСС, отобранных с площадок, на которых произошла вспышка, были разделены на кластеры трёх вариантов вируса, названных кладами (Таблица 2). Клад-1 состоял только из вакцинных штаммов, в то время как клад-2 и клад-3 состояли из вирусов дикого типа. Все варианты клада 1 были родственны с подтипом Lelystad PRRSV1-1 (Таблица 2). Другие сиквенсы вспышки были родственны с другим вирусом. Для вариантов из клада 2 самым близким сиквенсом был (MF600557.1), который первоначально был изолирован в Польше в 2010. Варианты вируса РРСС в кладе 3 были наиболее близки к сиквенсу, который был первоначально получен в России в 2005 году (EU071250.1). И сиквенс MF600557.1, и EU071250.1 были классифицированы как варианты вируса РРСС1 1-го подтипа. Среднее генетическое расстояние между кладами 1-3 варьировалось от 4 % до 15 %. Генетическое расстояние между кладом 1 и кладом 2 составило 4.2% (se = 1.9 %). Варианты клада 3 были наименее схожими с остальными кладами, имея генетическое расстояние в 15.3 % (se=8.5 %) и 15.4 % (se=8.4 %) от кладов 1 и 2 соответственно. Клады, связанные со вспышкой, были почти монофилетичными, идентичность в пределах клада была 99 % для каждого клада, что привело к 99 % схожести между сиквенсами в каждом кладе. В особенности, среднее расстояние в пределах клада составило 0.0 % (se=0.1 %), 0.9 % (se=0.4 %), и 0.4 % (se= 0.2 %) для кладов 1, 2 и 3 соответственно.
Для кладов 2 и 3 (вариантов дикого типа) отклонение и время до самого близкого предка, согласно вычислениям, произошло между 2018 и 2019 годами. Время до ближайшего общего предка для клада 2 получилось около июля 2019 при 95 % наивысшей апостериорной плотности (НАП) интервала между июнем 2015 и декабрём 2019. По кладу 3 время до ближайшего предка получилось в мае 2019 при 95% наивысшей апостериорной плотности интервала между мартом 2018 и декабрём 2019. Из анализа SkyGrid мы определили, что примерная вирусная популяция для обоих кладов начала увеличиваться в геометрической прогрессии примерно в июне 2019 г. (таблица 3).
Распределение кладов и движения свиней, которое способствовало распространению вируса
Регионы Воронеж и Липецк-Север в основном имели вирусные варианты клада 3. Регионы Тамбов, Пенза и Липецк-Юг имели вирусные варианты клада 2 и 3. Все пробы, которые не были просеквенированы, но были положительны по нуклеиновой кислоте вируса РРСС, были классифицированы как «неизвестные клады» (см рисунки 4a и 4b). На площадках в Тамбове и Пензе вирус РРСС был повторно диагностирован в течение нескольких месяцев (см рисунки 5a и 5b). Например, вспышка началась в Тамбовской области в марте 2020 года, когда был идентифицирован вирус клада 2. В этом регионе большая часть площадок была заражена в период с мая по июнь, но вспышка продолжилась и в октябре. Некоторые площадки имели несколько положительных результатов с интервалом в несколько месяцев. Например, вирус клада 2 был диагностирован на откорме 2А в августе и в октябре. В Пензе площадки первоначально были положительными в августе, и следующие положительные результаты в этом регионе пришли в октябре. Вирус клада 3 был идентифицирован на площадке откорм 1А в августе и вирус клада 2 был обнаружен в октябре (только вирус клада 2 виден на карте на рисунке 5b), а откорм 1Б получил положительный результат по вирусу клада 2 в оба этих месяца. Так как система широко использовала вакцину против РРСС, которая является кладом 1, все варианты клада 1 были исключены из оценки распространения, так как положительные результаты по этому типу были ожидаемы по всей системе.
Региональные перемещения свиней были связаны по времени и территориально с заражением площадок вирусом клада 3. Например, площадка Воронежского региона перемещала свиней в апреле на площадку Липецкого региона. Вирус клада 3 был обнаружен на площадке Воронежа на 19-ой неделе, а на Липецкой площадке на 20-ой. Свиней в Воронежском регионе постоянно перемещали с площадок, заражённых вирусом клада 3, на 19-ой неделе на площадку в Тамбовском регионе, на которой обнаружили вирус РРСС на 22-ой неделе. Не было меж-региональных перемещений, которые бы имели явно связанные площадки, которые были заражены вирусом клада 2.
Были различия в распределении кладов, но тип варианта в кладе не был связан с различиями в клиническом заболевании. Вирусы клада 3 были обнаружены на площадках развития ремсвинок, мультипликаторах и площадках подсоса (репродукторах), начиная с апреля 2020 года в Воронежском регионе. Последняя площадка подсоса, на которой был диагностирован вариант клада 3, была в Тамбовской области и имела положительный результат в октябре. Варианты, классифицированные как клад 3, были единственными вариантами, обнаруженными на площадках ремсвинок, мультипликаторах, и репродукторах. Варианты клада 3 были также обнаружены на доращиваниях, откормах и КУДО. Среди площадок данного типа первой площадкой, на которой был диагностирован вирус типа 3, была площадка в Липецкой области, которая имела положительные результаты в мае 2020 года, а последняя площадка находится в Пензенской области, и вирус в ней был диагностирован в октябре 2020 года. Вирусы клада 2 были также обнаружены на площадках доращивания, откорма и КУДО, но они не были обнаружены на площадках ремсвинок, в мультипликаторах и репродукторах. Клиническая тяжесть заболевания и падёж были связаны с типом производственной площадки, но не с кладом варианта вируса (см таблицу 1). На площадках доращивания были зарегистрированы более высокие уровни падежа и больше неврологических признаков, чем на откормах и репродукторах. Не смотря на эту разницу в распределении, клиническая картина не отличалась между кладами обнаруженных вариантов.
Было 26 площадок, которые имели результат ПЦР по обнаружению нуклеиновой кислоты БА, 23 были положительными и 3 – отрицательными. Тремя отрицательными площадками были площадки откорма, в том числе площадки КУДО. Положительными площадками были репродукторы, площадки доращивания и откорма, в том числе площадки КУДО. Имеется 94% уверенность, что инфекция БА была связана с клиническим заболеванием, когда имелась одновременная инфекция с вирусом РРСС (см таблицу 2).
Обсуждение
Данный опыт описывает вспышку РРСС, вызванную двумя вариантами вируса в коммерческом свиноводческом предприятии в России. При увеличивающейся доступности секвенирования и улучшении аналитических моделей производственные системы продолжают применять секвенирование для диагностики и изучения вспышек, включая оценку путей распространения патогенов. В данном опыте было отмечено, что не все случаи РРСС, отмеченные на 27 фермах данной компании, были все вызваны одним и тем же вирусом, патогенные вирусы принадлежали к двум разным кладам. Нам удалось оценить клинические картины и распределение вируса на основе клада и проследить появление штаммов.
Секвенирование ORF5 вируса РРСС показало, что данное свиноводческое предприятие имело тяжёлую вспышку РРСС в 2020 году с двумя явными сиквенсами, которые относятся к ранее обнаруженному дикому типу вирусного варианта РРСС1-1. Тяжёлое заболевание не является характерным для РРСС1-1. Исторически вирусы подтипа 1 обычно имеют низкую патогенность (Yuzhakov et al., 2020). Клиническая картина, характерная для РРСС, статистически не связана с вирусными кладами, но разнится по стадии производства. Секвенирование было единственным инструментом, с помощью которого компания была проинформирована, что произошло заражение двумя разными типами вируса. Без секвенирования компания не знала бы, что имела дело с двумя вспышками, вызванными одинаковым родом вирусов.
Согласно оценке, вирусные штаммы циркулировали в регионах, как минимум, последние 2 года до вспышки. Эффективная популяция данных вирусов выросла в геометрической прогрессии в период с июня по декабрь 2019 года (таблица 2). Увеличение, возможно, произошло из-за некоторого беспорядка в популяции свиней, который вызвал изменение динамики циркуляции вируса в регионе, что и привело к вспышке, зарегистрированной в 2020 году в данной производственной системе. Беспорядок в популяции свиней мог произойти из-за перемещений животных или из-за изменений в иммунном профиле животных, на который могли повлиять протоколы иммунизации. Дальнейшее исследование и сравнение иммунного ответа этих «новых» штаммов с тем штаммом, который предоставляется вакциной, используемой в регионе, возможно, прольёт свет на обнаруженную динамику циркулирующих вирусов.
В общем, на 9 фермах был диагностирован клад 2, и на 15 – клад 3. Имелась разница в моделях распространения на фермах вирусов клада 2 и 3. Процент ферм, заражённых вирусом РРСС, увеличился после появления в холдинге вирусов клада 3 в апреле 2020 года. Клад 2 был диагностирован только на одной площадке откорма в марте 2020 года, а затем в апреле на площадке-мультипликаторе был диагностирован вирус клада 3. Заражение площадки мультипликатора могло произойти как результат распространения в окружающей среде или воздушно-пылевым путём. Ещё одна компания в Воронежском регионе также проходила через вспышку генетически похожего типа РРСС. Общая дорога, которая проходила через Воронежскую площадку, использовалась данной компанией для перевозки инфицированных свиней в то время, когда заразилась эта площадка (информация получена от директора по производству заражённой фермы).
Другая динамика передачи вируса была связана со стандартным перемещением свиней между площадками. В течение времени изучения площадки развития ремсвинок, мультипликаторы и репродукторы имели только вирусы клада 3, в то время, как площадки доращивания, откорма и КУДО имели вирусы клада 2 и 3. Двойное заражение товарных площадок было ожидаемым. Вирус клада 3 был занесён на площадки, так как поросята с репродукторов, заражённых вирусами клада 3, были отправлены на площадки доращивания, откорма и КУДО, и занесли инфекцию. Обратного движения на репродуктор не было, что не позволило им заразиться вирусом клада 2. Площадки откорма, заражённые вирусом клада 2, имели контакт с площадками доращивания в пределах регионов и могли заразить их. Вероятно, это было сделано посредством переносчиков (например, транспорта и персонала). Непонятно, как вирус распространился в Пензенский регион, но есть вероятность, что здесь также сыграли роль переносчики. Перемещения клада 3 в данном холдинге включали в себя использование мультипликатора для репопуляции системы развития ремсвинок. В результате свиньи не перемещались с площадок, заражённых вирусом клада 2 (площадки доращивания, откорма и КУДО), на репродукторы. Вирусы клада 3 были распространены на репродукторы, когда ремсвинки с Воронежского мультипликатора были перемещены на площадки развития ремсвинок и репродукторы в разных регионах.
Перемещения свиней предопределили распространение заболевания. Защиту маточного поголовья лучше всего было осуществить, предотвратив обратное движение свиней с площадок доращивания, откорма и КУДО на площадки развития ремсвинок. Это доказало защиту репродукторов, так как они не были заражены типами клада 2, но это не предоставило защиту площадкам доращивания, так как они были заражены вирусами клада 2, которые первоначально обнаруживался на откормах. Общий персонал и оборудование могли быть причиной заражения площадок доращивания вирусами клада 2. Из-за разного уровня биобезопасности на производственных площадках необходимо провести наблюдение на площадках доращивания, откорма и КУДО для определения того, какие вирусы циркулируют на ферме.
Самое тревожное наблюдение из этого опыта заключалось в том, что за короткий промежуток времени предприятие заразили два отдельных клада вируса РРСС (клада 2 и 3). Эти варианты родственны с другим патогенным вирусом РРСС, который циркулировал несколько лет, и данные показывают, что эти два варианта появились в начале 2020 года. Эти наблюдения вызывают беспокойство по поводу биобезопасности холдинга. Два данных изолята заразили предприятие с интервалом в три месяца. Есть данные о перемещении животных между площадками после того, как ферма уже имела положительный статус. Также проблемой могли быть плохое качество обработки транспорта или невозможность помыть транспорт на площадке, куда были доставлены свиньи. Принимая во внимание передачу вируса РРСС воздушно-пылевым путём (Dee et al., 2005), присутствие ЛПХ вокруг площадок Воронежской области также могло послужить увеличенному давлению заболевания, если на них не обеспечивается должный уровень биобезопасности и контроль патогенов. Необходимы полноценные и постоянные меры биобезопасности, так как очевидно, что в регионе имеется высокое давление вируса РРСС. Дооснащение ферм системами фильтрации воздуха может помочь несколько снизить это давление, уменьшив перенос вируса на площадки. (Dee et al., 2005).
В этом исследовании использовались данные недавней вспышки в коммерческой свиноводческой компании, которая проводила ПЦР-диагностику для определения нуклеиновой кислоты вируса РРСС, а также секвенирование. В холдинге были активные перемещения свиней, а также клинические и диагностические данные по БА. Возможность оценки распределения изолятов специфичных кладов была ограничена, так как только 28 проб были просеквенированы и классифицированы. Также оценку ограничил тот факт, что исследования на сопутствующие заболевания были непостоянны, а методы, используемые для описания клинических признаков и уровня падежа, не были стандартизированы. Тем не менее, были предложены некоторые меры для улучшения ситуации. Разумеется, система обеспечения биобезопасности должна постоянно оцениваться и улучшаться. Перемещения свиней с площадок, ожидающих результаты диагностики, должны быть ограничены, или свиней необходимо помещать в карантин на принимающих площадках. Вирус РРСС активно распространяется по этому региону, и есть некоторые доказательства, что заразить ферму могло соседнее предприятие, что может быть сглажено, если будет использована система фильтрации воздуха на ферме, а именно в мультипликаторах и репродукторах, так как именно с этих площадок начинаются основные перемещения свиней. Также понимание зависимости между тенденциями вакцинаций, иммунного ответа к новым штаммам и влияние этих штаммов на производство может помочь в ранней детекции более проблемных полевых штаммов. И, наконец, данное исследование доказывает преимущества секвенирования и техник молекулярной эпидемиологии для коммерческих свиноводческих предприятий. Эта возможность позволила распознать несколько вариантов вируса РРСС и связать распространение вариантов с перемещениями свиней по регионам. Секвенирование и идентификация вариантов должны проводиться на постоянной основе по интересующим заболеваниям.
Конфликт интересов
Черкизово является клиентом Pipestone Applied Research.
Финансирование
Внешнего финансирования, которое поддерживало бы этот проект, не было.
Ссылки
Cromwijk, W. A. (1991). [A new virus disease in swine]. Tijdschrift Voor Diergeneeskunde, 116(5), 247–248.
Dee, S., Batista, L., Deen, J., & Pijoan, C. (2005). Evaluation of an air-filtration system for preventing aerosol transmission of Porcine reproductive and respiratory syndrome virus. Canadian Journal of Veterinary Research = Revue Canadienne De Recherche Veterinaire, 69(4), 293–298.
Felsenstein, J. (1981). Evolutionary trees from DNA sequences: A maximum likelihood approach [Article]. Journal of Molecular Evolution, 17(6), 368–376. https://doi.org/10.1007/BF01734359
Gill, M. S., Lemey, P., Faria, N. R., Rambaut, A., Shapiro, B., & Suchard, M. A. (2013). Improving bayesian population dynamics inference: A coalescent-based model for multiple loci. Molecular Biology and Evolution, 30(3), 713–724. https://doi.org/10.1093/molbev/mss265
Hill, H. (1990). Overview and history of mystery swine disease (swine infertility/respiratory syndrome). Proceedings from the Mystery Swine Disease Committee Meeting, 29–31.
ICTV Ninth Report on Virus Classification and Taxon Nomenclature (Virus Taxonomy: 2019 Release EC 51). (2011). International Committee on Taxonomy of Viruses (ICTV). https://talk.ictvonline.org/ictv-reports/ictv_9th_report/positive-sense-rna-viruses-2011/w/posrna_viruses/220/arteriviridae
Larsson, A. (2014). AliView: A fast and lightweight alignment viewer and editor for large datasets. Bioinformatics, 30(22), 3276–3278. https://doi.org/10.1093/bioinformatics/btu531
Martin, D. P., Murrell, B., Golden, M., Khoosal, A., & Muhire, B. (2015). RDP4: Detection and analysis of recombination patterns in virus genomes. Virus Evolution, 1(1), 1–5. https://doi.org/10.1093/ve/vev003
Miller, M. A., Pfeiffer, W., & Schwartz, T. (2010). Creating the CIPRES Science Gateway for inference of large phylogenetic trees. 2010 Gateway Computing Environments Workshop (GCE), 1–8. https://doi.org/10.1109/GCE.2010.5676129
Morgan, S. B., Graham, S. P., Salguero, F. J., Sánchez Cordón, P. J., Mokhtar, H., Rebel, J. M. J., Weesendorp, E., Bodman-Smith, K. B., Steinbach, F., & Frossard, J. P. (2013). Increased pathogenicity of European porcine reproductive and respiratory syndrome virus is associated with enhanced adaptive responses and viral clearance. Veterinary Microbiology, 163(1–2), 13–22. https://doi.org/10.1016/j.vetmic.2012.11.024
Murtaugh, M. P., Elam, M. R., & Kakach, L. T. (1995). Comparison of the structural protein coding sequences of the VR-2332 and Lelystad virus strains of the PRRS virus. Archives of Virology, 140(8), 1451–1460. https://doi.org/10.1007/BF01322671
Raev, S., Yuzhakov, A., Bulgakov, A., Kostina, L., Gerasianinov, A., Verkhovsky, O., Zaberezhny, A., & Aliper, T. (2020). An Outbreak of a Respiratory Disorder at a Russian Swine Farm Associated with the Co-Circulation of PRRSV1 and PRRSV2. Viruses, 12(10). https://doi.org/10.3390/v12101169
Rambaut, A., Drummond, A. J., Xie, D., Baele, G., & Suchard, M. A. (2018). Posterior Summarization in Bayesian Phylogenetics Using Tracer 1.7. Systematic Biology, 67(5), 901–904. https://doi.org/10.1093/sysbio/syy032
Rambaut, A., Lam, T. T., Max Carvalho, L., & Pybus, O. G. (2016). Exploring the temporal structure of heterochronous sequences using TempEst (formerly Path-O-Gen). Virus Evolution, 2(1), vew007. https://doi.org/10.1093/ve/vew007
Suchard, M. A., Lemey, P., Baele, G., Ayres, D. L., Drummond, A. J., & Rambaut, A. (2018). Bayesian phylogenetic and phylodynamic data integration using BEAST 1.10. Virus Evolution, 4(1), 1–5. https://doi.org/10.1093/ve/vey016
Tavare, S. (1986). Some probabilistic and statistical problems in the analysis of DNA sequences. Lect. Math. Life Sci., 17(2), 56–86.
Terpstra, C., Wensvoort, G., & Pol, J. (1991). Experimental reproduction of porcine epidemic abortion and respiratory syndrome (mystery swine disease) by infection with Lelystad virus: Koch’s postulates fulfilled. Veterinary Quarterly, 13, 131–136.
Wensvoort, G., Terpstra, C., Pol, J. M. A., ter Laak, E. A., Bloemraad, M., de Kluyver, E. P., Kragten, C., van Buiten, L., den Besten, A., Wagenaar, F., Broekhuijsen, J. M., Moonen, P. L. J. M., Zetstra, T., de Boer, E. A., Tibben, H. J., de Jong, M. F., van ‘t Veld, P., Greenland, G. J. R., van Gennep, J. A., … Braamskamp, J. (1991). Mystery swine disease in the Netherlands: The isolation of Lelystad virus. Veterinary Quarterly, 13(3), 121–130. https://doi.org/10.1080/01652176.1991.9694296
Wensvoort, Gert, de Kluyver, E. P., Pol, J. M. A., Wagenaar, F., Moormann, R. J. M., Hulst, M. M., Bloemraad, R., Besten, A. den, Zetstra, T., & Terpstra, C. (1992). Lelystad virus, the cause of porcine epidemic abortion and respiratory syndrome: A review of mystery swine disease research at Lelystad. Veterinary Microbiology, 33(1–4), 185–193. https://doi.org/10.1016/0378-1135(92)90046-V
Yu, G. (2020). Using ggtree to Visualize Data on Tree‐Like Structures. Current Protocols in Bioinformatics, 69(1), 1–18. https://doi.org/10.1002/cpbi.96
Yuzhakov, A. G., Raev, S. A., Shchetinin, A. M., Gushchin, V. A., Alekseev, K. P., Stafford, V. V., Komina, A. K., Zaberezhny, A. D., Gulyukin, A. M., & Aliper, T. I. (2020). Full-genome analysis and pathogenicity of a genetically distinct Russian PRRSV-1 Tyu16 strain. Veterinary Microbiology, 247, 108784. https://doi.org/10.1016/j.vetmic.2020.108784
Yuzhakov, A. G., Raev, S. A., Skrylev, A. N., Mishin, A. M., Grebennikova, T. V., Verkhovsky, O. A., Zaberezhny, A. D., Trus, I., Nauwynck, H. J., & Aliper, T. I. (2017). Genetic and pathogenic characterization of a Russian subtype 2 PRRSV-1 isolate. Veterinary Microbiology, 211, 22–28. https://doi.org/10.1016/j.vetmic.2017.09.017